-
Project IDG2013-105
-
受領年2013
-
投資金額¥71,450,000病気Malaria対象Vaccine開発段階Phase1 Clinical Developmentパートナー大阪大学微生物病研究所 , グル大学論文
-
Tougan T, Ito K, Palacpac NM, Egwang TG, Horii T. Immunogenicity and protection from malaria infection in BK-SE36 vaccinated volunteers in Uganda is not influenced by HLA-DRB1 alleles. Parasitol Int. 2016 Oct;65(5 Pt A):455-8. doi: 10.1016/j.parint.2016.06.012. Epub 2016 Jun 23. PMID: 27343834.
-
Yatsushiro S, Yamamoto T, Yamamura S, Abe K, Obana E, Nogami T, Hayashi T, Sesei T, Oka H, Okello-Onen J, Odongo-Aginya EI, Alai MA, Olia A, Anywar D, Sakurai M, Palacpac NM, Mita T, Horii T, Baba Y, Kataoka M. Application of a cell microarray chip system for accurate, highly sensitive, and rapid diagnosis for malaria in Uganda. Sci Rep. 2016 Jul 22;6:30136. doi: 10.1038/srep30136. PMID: 27445125; PMCID: PMC4995311.
-
Yagi M, Palacpac NM, Ito K, Oishi Y, Itagaki S, Balikagala B, Ntege EH, Yeka A, Kanoi BN, Katuro O, Shirai H, Fukushima W, Hirota Y, Egwang TG, Horii T. Antibody titres and boosting after natural malaria infection in BK-SE36 vaccine responders during a follow-up study in Uganda. Sci Rep. 2016 Oct 5;6:34363. doi: 10.1038/srep34363. PMID: 27703240; PMCID: PMC5050508.
-
Balikagala B, Mita T, Ikeda M, Sakurai M, Yatsushiro S, Takahashi N, Tachibana SI, Auma M, Ntege EH, Ito D, Takashima E, Palacpac NM, Egwang TG, Onen JO, Kataoka M, Kimura E, Horii T, Tsuboi T. Absence of in vivo selection for K13 mutations after artemether-lumefantrine treatment in Uganda. Malar J. 2017 Jan 9;16(1):23. doi: 10.1186/s12936-016-1663-1. PMID: 28068997; PMCID: PMC5223472.
-
Odongo-Aginya EI, Olia A, Luwa KJ, Nagayasu E, Auma AM, Egitat G, Mwesigwa G, Ogino Y, Kimura E, Horii T. Wuchereria bancrofti infection at four primary schools and surrounding communities with no previous blood surveys in northern Uganda: the prevalence after mass drug administrations and a report on suspected non-filarial endemic elephantiasis. Trop Med Health. 2017 Aug 15;45:20. doi: 10.1186/s41182-017-0060-y. Erratum in: Trop Med Health. 2017 Sep 20;45:28. PMID: 28814926; PMCID: PMC5556395.
-
Ikeda M, Kaneko M, Tachibana SI, Balikagala B, Sakurai-Yatsushiro M, Yatsushiro S, Takahashi N, Yamauchi M, Sekihara M, Hashimoto M, Katuro OT, Olia A, Obwoya PS, Auma MA, Anywar DA, Odongo-Aginya EI, Okello-Onen J, Hirai M, Ohashi J, Palacpac NMQ, Kataoka M, Tsuboi T, Kimura E, Horii T, Mita T. Artemisinin-Resistant Plasmodium falciparum with High Survival Rates, Uganda, 2014-2016. Emerg Infect Dis. 2018 Apr;24(4):718-726. doi: 10.3201/eid2404.170141. PMID: 29553316; PMCID: PMC5875287.
-
Tougan T, Edula JR, Takashima E, Morita M, Shinohara M, Shinohara A, Tsuboi T, Horii T. Molecular Camouflage of Plasmodium falciparum Merozoites by Binding of Host Vitronectin to P47 Fragment of SERA5. Sci Rep. 2018 Mar 22;8(1):5052. doi: 10.1038/s41598-018-23194-9. PMID: 29567995; PMCID: PMC5864917.
-
Ezoe S, Palacpac NMQ, Tetsutani K, Yamamoto K, Okada K, Taira M, Nishida S, Hirata H, Ogata A, Yamada T, Yagi M, Edula JR, Oishi Y, Tougan T, Ishii KJ, Myoui A, Horii T. First-in-human randomised trial and follow-up study of Plasmodium falciparum blood-stage malaria vaccine BK-SE36 with CpG-ODN(K3). Vaccine. 2020 Oct 27;38(46):7246-7257. doi: 10.1016/j.vaccine.2020.09.056. Epub 2020 Oct 2. PMID: 33012605.
-
Tougan T, Edula JR, Morita M, Takashima E, Honma H, Tsuboi T, Horii T. The malaria parasite Plasmodium falciparum in red blood cells selectively takes up serum proteins that affect host pathogenicity. Malar J. 2020 Apr 15;19(1):155. doi: 10.1186/s12936-020-03229-1. PMID: 32295584; PMCID: PMC7161009.
-
Balikagala B, Sakurai-Yatsushiro M, Tachibana SI, Ikeda M, Yamauchi M, Katuro OT, Ntege EH, Sekihara M, Fukuda N, Takahashi N, Yatsushiro S, Mori T, Hirai M, Opio W, Obwoya PS, Anywar DA, Auma MA, Palacpac NMQ, Tsuboi T, Odongo-Aginya EI, Kimura E, Ogwang M, Horii T, Mita T. Recovery and stable persistence of chloroquine sensitivity in Plasmodium falciparum parasites after its discontinued use in Northern Uganda. Malar J. 2020 Feb 18;19(1):76. doi: 10.1186/s12936-020-03157-0. PMID: 32070358; PMCID: PMC7026951.
-
Ntege EH, Arisue N, Ito D, Hasegawa T, Palacpac NMQ, Egwang TG, Horii T, Takashima E, Tsuboi T. Identification of Plasmodium falciparum reticulocyte binding protein homologue 5-interacting protein, PfRipr, as a highly conserved blood-stage malaria vaccine candidate. Vaccine. 2016 Nov 4;34(46):5612-5622. doi: 10.1016/j.vaccine.2016.09.028. Epub 2016 Sep 28. PMID: 27692771.
-
Draper SJ, Angov E, Horii T, Miller LH, Srinivasan P, Theisen M, Biswas S. Recent advances in recombinant protein-based malaria vaccines. Vaccine. 2015 Dec 22;33(52):7433-43. doi: 10.1016/j.vaccine.2015.09.093. Epub 2015 Oct 11. PMID: 26458807; PMCID: PMC4687528.
イントロダクション/背景
Med Biotech Laboratories (MBL)及び大阪大学微生物病研究所は約10年間に亘ってBK-SE36マラリアワクチンに関する共同研究を実施し、この度、マラリア高度流行地であるウガンダのリラにおいてGCP遵守のPhase Ib相臨床試験(6−40歳を対象)を成功裡に終了しました。本臨床試験においてBK-SE36マラリアワクチンの安全性と免疫原性を確認すると同時に、6-20歳の年齢群を第二回接種後から130—365日に亘って追跡調査したところ、ワクチン接種群において原虫率(>5000 原虫数/µL)と発熱(37.5℃以上)を伴うマラリアに対して72%の発症防御効果を観察しました。しかしながらマラリア感染経験のない日本人を対象に実施した Phase Ib相臨床試験では披験者全員がワクチンに対して免疫応答を示したのに対して、流行地域においては免疫応答が低く、特に高い年齢群ではこの傾向が顕著でした。
従って、微生物病研究所ではBK-SE36マラリアワクチンの免疫原性を高めるため、より強力なアジュバントであるCpGを加えた次世代BK-SE36/CpG製剤の非臨床研究を実施してきました。CpG オリゴヌクレオチド (CpG ODN)はワクチンアジュバントとして開発された一本鎖の短い合成DNAです。動物実験で良好な結果がえられたことから、前臨床試験(GLP)を実施し、現在は、大阪大学医学部附属病院未来医療センターの医師主導の下、マラリア感染経験のない成人日本人において第Ia相臨床試験(First in human)を実施しております。さらに、マラリア流行地においてワクチン効果を検討するため、2010年の後半から、「途上国におけるイノベーションを促進する国際協力の戦略的推進」プログラムによりウガンダ・グル大学との共同研究を開始しました。本研究課題ではワクチン製剤型を確定するため、第Ia相臨床試験における安全性および免疫原性の標準的な解析に加えて、我々は日本人ボランティアでワクチン誘導された抗体、第Ib相臨床試験でワクチン誘導された抗体、自然獲得抗体について比較検討を行う予定です。
本プロジェクトによって、グローバルヘルスの課題はどのように解決されますか?
本共同研究においては、地球規模で必要とされるマラリアワクチンの開発に資することを目的としています。有効なマラリアワクチンは未だに存在せず、マラリアに対する防御免疫のメカニズムも明らかにされていません。従来の免疫反応の解析に加えて、他の種々の手法を用いて最適なワクチンの開発をするという本課題で提案した国際共同研究によるワクチン開発によってマラリア犠牲者/患者の減少が期待されます。
抗原に免疫腑活化アジュバントを追加することで、ワクチン免疫応答を増強するという考え方は 一般的に受け入れられています。しかしながら市販のアジュバントには効果や安全性に限界があり、それを補うアジュバントの欠如がマラリアワクチン開発の障害となっています。現在、感染症に対する承認ワクチンにはいくつかの新規のアジュバントが使用されていますが、それらアジュバントの科学的根拠は解明されていません。これらの事実を踏まえて、大阪大学医学部附属病院未来医療センターでは、医師主導型治験として、強力な液性及び細胞性免疫を誘導するCpG製剤であるBK-SE36/CpGの臨床試験を実施しております。本研究ではグル大学と共同し、日本人ボランティアでワクチン誘導された抗体、第Ib相臨床試験でワクチン誘導された抗体、自然獲得抗体について防御抗体としての能力を比較検討することにより、BK-SE36/CpGのマラリア防御免疫機構を明確に示す事を目的とします。
本プロジェクトが革新的である点は何ですか?
BK-SE36/AHG(水酸化アルミニウムゲル)にCpGを加えることにより、より一層強い抗体陽転が期待されます。CpGは他の感染症ワクチンや他の免疫原性に乏しいマラリアワクチン抗原に加えた場合に、免疫原性を向上させること、さらに、ワクチン誘発性反応の加速及び免疫不全患者における免疫応答の増強効果も報告されています。CpGの作用機序及びアジュバント/抗原の組み合わせによる免疫応答の解明は、BK-SE36の理解を深め、一般住民のみならず脆弱な、例えば、乳幼児や免疫応答の弱い高齢者のためにより強力で安定なマラリアワクチンを提供することが期待されます。
他(参考文献、引用文献など)
(1) Palacpac N.M.Q., Ntege E., Yeka A. Balikagala B., Suzuki N., Shirai H., Yagi M., Ito K., Fukushima W., Hirota Y., Nsereko C., Okada T., Kanoi B.N., Tetsutani K., Arisue N., Itagak S., Tougan T., Ishii K.J., Ueda S., Egwang T.G., and Horii T.
Phase 1b randomized trial and follow-up study in Uganda of the blood-stage malaria vaccine candidate BK-SE36. PLoS ONE. 2013; 8(5): e64073.
(2) Palacpac N.M. Q., Arisue N., Tougan T., Ishii K. J. and Horii T.
Plasmodium falciparum serine repeat antigen 5 (SERA5) as a malaria vaccine candidate. Vaccine. 2011Aug 11;29(35):5837-45.
(3) Horii T, Shirai H, Jie L, Ishii KJ, Palacpac NQ, Tougan T, Hato M, Ohta N, Bobogare A, Arakaki N, Matsumoto Y, Namazue J, Ishikawa T, Ueda S, Takahashi M .
Evidences of protection against blood-stage infection of Plasmodium falciparum by the novel protein vaccine SE36. Parasitol Int. 2 010 Sep;59(3):380-6.日本で我々が独自に開発したBK-SE36マラリアワクチン
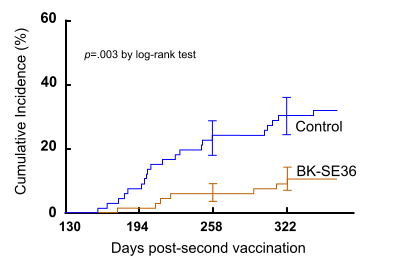
図 カプランマイヤープロットで見るBK-SE36ワクチン接種群で72%の防御効果
血中の原虫数≥5000/μLと37.5℃以上の発熱を同時に見た場合をマラリア発症として計測される。
他のワクチンと比較するため、図ではBK-SE36の1.0mL接種群と0.5mL接種群の合算(赤線)である。
この結果は対照群に比べて72%の発症防御を示している(p=0.03)。
最終報告書
1. プロジェクトの目的
本プロジェクトは高い液性及び細胞性免疫応答が期待される自然免疫刺激アジュバントを添加した赤血球期マラリアワクチンBK-SE36/CpGの第I相臨床試験の実施である。アジュバントの評価項目は安全性、免疫原性及び誘導される抗体の性状である。
2. プロジェクト・デザイン
日本人を対象とした単盲、無作為化、プラセボ対照とした2容量(半量及び全量)による臨床試験とする。安全性、免疫原性及び生物学的な評価とともに、IgGサブクラス、防御エピトープ及び接種者の原虫増殖阻害効果をアフリカ流行地住民のそれらと比較する。
3.プロジェクトの結果及び考察
日本における第Ia相臨床試験において、K3 CpG アジュバントと混合したBK-SE36 は安全性が認められ、BK-SE36 (水酸化アルミニュームゲルのみ)に比べて3-4倍高い抗体価が誘導された。また、本マラリアワクチン候補の有効性の評価基準となる生物学的な解析(IgGサブクラス、エピトープ解析及び原虫増殖阻害試験)を実施した。我々は解析結果の感度と特異性を変動させる要因を比較検討することにより、対照血清や種々の試薬を選択し、高い信頼性を確立した。確立した方法は 解析結果の評価や比較を容易かつ確実なもとし、BK-SE36及び BK-SE36/CpGの開発促進に役立つものである。 物理化学的な解析からSE36蛋白質のエピトープ(下記の2領域)は天然変性領域であり、防御抗体を誘導する上で厳密な3次元立体構造を必要としないことが明らかとなった。防御抗体の誘導に厳密な立体構造を必要とする他のいくつかのワクチン候補抗原に比べて大量生産する上で有利である。自然感染により誘導されたウガンダ人の血清は、これまで報告されてきた遺伝子多型の少ないオクタマ−レピート及びセリンリッチ配列に主として反応する。これはワクチン開発の障害となる遺伝子多型を克服することが期待される。一方、ワクチン接種の血清はセリンの反復配列の周辺領域に反応する。この領域はマウスやリスザルでのワクチン試験で観察されたエピトープであり、感染実験で高い原虫率を示さないことが示されている。さらにBK-SE36/CpGを接種した被験者の血清は培養マラリア原虫の増殖を強く阻害することが示された。 本プロジェクトで示されたBK-SE36/CpGの安全性、免疫原性及びその生物学的な機能についての解析結果は、本ワクチンの流行地におけるさらなる臨床試験実施の推進に資するものである。
Investment
プロジェクト
BK-SE36/CpGマラリアワクチンの臨床開発




