-
Project IDT2015-134
-
受領年2015
-
投資金額¥29,713,377病気Malaria対象Drug開発段階Target Validationパートナー武田薬品工業株式会社 , Medicines for Malaria Venture (MMV) , メルボルン大学
イントロダクション/背景
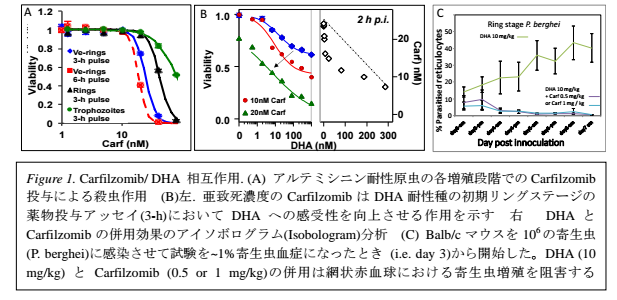
熱帯熱マラリア原虫(Plasmodium falciparum)は、毎年200 万のマラリア感染を引き起こし、およそ58 万人を死に至らしめている(2014 年WHO ワールド・マラリア・レポ ートより)。 現在のマラリア治療は、アルテミシニン(artemisinins) として知られる 1 種類の治療薬に大きく依存しており、東南アジアでは、アルテミシニン に対する耐性種の発生が大きな問題となっている(Ashley et al., N Engl J Med 371, 411 (2014)) 。 このため、アルテミシニン 耐性種を克服するため、新規抗マラリア薬創製の必要性が急速に高まっている。 本プロジェクトに先駆けて、我々は、熱帯熱マラリア原虫のもつプロテアソームに対する阻害薬、すなわち、変性タンパク質の分解において重要な役割を担うたんぱく質分解酵素に対して阻害作用を示す薬剤が、抗マラリア原虫作用を示すことを発見した。この抗マラリア原虫作用は、アルテミシニン感受性原虫、及び、耐性原虫の双方に対して有効である上、赤血球内増殖期の全ての段階、特に、他の多くの化学療法剤に対して耐性を示すマラリア原虫の初期段階(リングステージ)にも有効であることを見出した。(Figure 1, panel A 参照) 。 さらに、このプロテアソーム阻害薬の熱帯熱マラリア原虫に対する効果は、アルテミシニンへの感受性の有無にかかわらず、アルテミシニンの作用との強い相乗効果を持つことを発見した。(Figure 1, panel B 参照)。 重要なことに、この相乗効果は、マラリア原虫(P. berghei)に対して、マウスの動物試験においても、観察された。(Figure 1, panel C 参照)。このことから、熱帯熱マラリア原虫に選択性をもつプロテアソーム阻害薬は、マラリア治療薬としてそれ自体を単独投与することによって、さらには、アルテミシニン・ベース混合療法に用いることによって、有望な治療方法となることを示している。
本プロジェクトによって、グローバルヘルスの課題はどのように解決されますか?
マラリアの治療はアルテミシニン・ベース混合治療(ACTs)に強く依存しているため、アルテミシニン耐性種の蔓延が非常に深刻な結果をもたらすことが予想される。世界保健機構は、「耐性種がインド又はサハラ以南のアフリカ諸国に蔓延した場合、又は、そこで発生した場合、公衆衛生問題は悲惨な状況となる可能性がある。ひとつの地域の公衆衛生に関する問題を解決するチャンスが現状では非常に限られているため、これが全世界的に重大な影響を与える危機に発展する恐れがある。」と警告している。 すなわち、耐性種がインド国境近くのミャンマーを含む 6 つの東南アジア諸国で発見されていることは、重大な懸念であるということを意味している(Tun et al. Lancet Infect Dis 15, 415 (2015))。 世界的にアルテミシニン・ベース混合治療の 30%が無効となってしまう事態に陥った場合、毎年、11 万 6000 人の死者が増加し、3 億 8500 万米ドル(5億 1300 万豪ドル)の経済損失の追加が推定される(Lubell et al. Malar J 13, 452 (2014))。 本プロジェクトは熱帯熱マラリア原虫プロテアソームに対して特異的かつ有効な活性を示す化合物の効率的な創製を可能にするアッセイ方法を開発することを目的としている。これらのプロテアソーム活性測定アッセイ系は、様々な機関から提供される化合物の有効性の証明と薬物プロファイリングを実施するための試験項目(スクリーニング・カスケード)の一部を構成するものとなる。
本プロジェクトが革新的である点は何ですか?
本プロジェクトの最も興味深い重要な点は、アカデミック・パートナー(リアン・ティリー氏)、製薬業界の専門家(ディック・ラリー氏)及び製品開発パートナー(ジェレミー・ブロウズ氏、MMV)によって協働して進められるところである。 我々の研究チームは、長年に渡りプロテアソーム阻害薬の抗がん剤としての研究開発の過程で蓄積してきた成果の集約を基点に結成される。我々は、この集約した知見を新しい抗マラリア薬の研究開発に生かすことが出来る。ディック・ラリー氏の参画は、彼がBortezomib 及び Ixazomib の創製に関わった経験を応用するという観点から、特に重要である。彼は、特にプロテアソームを治療ターゲットとする研究開発に従事してきており、この酵素に強い学術的関心をもっている。 我々のプロジェクトの技術的革新点(イノベーション)は、高度に特異的な抗熱帯熱マラリア原虫への生理活性及びその薬剤耐性獲得阻害機作に関連するプロテアソーム阻害薬の"手掛かり" の発見である。我々は、この化学的"手掛かり"が、アルテミシニン耐性を示す熱帯熱マラリア原虫プロテアソームに存在するβ2及びβ5サブユニットの両方に有効であることにあるが、一方で、哺乳類の存在するプロテアソームに対する作用が弱いか、若しくは、哺乳類プロテアソームのβ2サブユニットに対してのみ作用があるものとなることを予測している。これは、マラリア患者の治療に使用することを最終目標とした、有効で、かつ、安全な薬剤候補を創製していくなかで、重要な点となるであろう。
各パートナーの役割と責任
武田薬品工業株式会社の子会社でボストンの研究施設を保有するミレニアムファーマシューティカルズのOncology Clinical R&Dに所属するサイエンティフィックフェローのラリー・ディック博士(Larry Dick)をはじめとする研究者は、ボルテゾミブとイキサゾミブの創薬研究・臨床開発を通じて、プロテアゾーム阻害薬の研究開発に関する長年の経験と知識を蓄積している。この経験と知識を、今回は抗マラリア薬の研究に応用していくことになる。ミレニアムファーマシューティカルズは、その研究施設にメルボルン大学の研究者であるスタンレー・シエ博士(Stanley Xie)を2週間迎え入れ、ヒトプロテアゾームの活性測定や生化学研究手法の修得をサポートする。このとき、既に武田で見出されているプロテアゾーム阻害活性を示す化合物に関して、シエ博士がメルボルン大学で開発した活性測定方法を用いて、そのマラリア原虫(P. falciparum)由来プロテアゾームへの阻害活性も測定する予定である。
Medicines for Malaria Venture (MMV)のDrug Discovery部門に所属するジェレミー・ブロウズ博士(Jeremy Burrows)は、抗マラリア薬研究開発のために様々な提携を長年に渡り実施してきた。ブロウズ博士はこの研究開発業務における専門的な知見を提供することによって、薬剤標的の検証や試験手法の新規開発をサポートしている。このブロウズ博士の知見と経験は、初期段階の薬剤探索を行う実験においても非常に精度が高く安定した結果を出すことに大いに貢献するであろう。また、前臨床化合物としてその後の臨床開発に適した有望なプロファイルを持つ化合物を見出せるよう、今後の最適化研究においても戦略の検討とアドバイスを実施している。さらにブロウズ博士は武田薬品工業株式会社(ミレニアム社を含む)が保有する化合物群の評価が円滑に進むようにサポートと、本研究から得られる成果に対しても助言を行っていく予定である。
本プロジェクトにはメルボルン大学がパートナーとして参画しており、タイレー教授(Tilley)は本プロジェクトを指揮して、研究計画の立案、研究予算の管理調整、およびチーム内コミュニケーションの促進に対して各パートナーと共同で取り組み、さらにGHITへの報告を行う。マラリア原虫(P. falciparum)プロテアゾームに対して特異的(選択的)かつ強力な阻害活性を有する化合物を選別する試験手法を開発するために、メルボルン大学は研究室スペースおよび研究人員を提供している。またマラリア原虫からの抽出物および精製プロテアゾームを使用した、発光法および蛍光法による試験研究手法の検証および新規開発もこの目的に含まれる。これらのプロテアゾーム活性に関する試験手法は、武田薬品工業株式会社(ミレニアム社を含む)や他のスクリーニング化合物ライブラリーから見出された化合物の検証や生理活性プロファイリングのための試験スキームに組み込まれる予定である。
最終報告書
1. プロジェクトの目的
本プロジェクトは、ヒト細胞には毒性を示さず、熱帯熱マラリア原虫特異的に効果を発揮する、マラリア選択的プロテアソーム阻害薬のためのアッセイ法の開発を目的とした。また、アルテミシン耐性マラリアの根絶に繋がるプロテアソーム阻害薬を創出するために、化合物ライブラリーの利用が可能となるよう武田薬品と協働した。
2. プロジェクト・デザイン
a) マラリア原虫の20Sプロテアソーム抽出
b) 哺乳類PA28(プロテアソーム活性化因子)の調製
c) マラリア原虫20Sプロテアソーム活性の蛍光評価法の最適化
d) 上記評価法を用いた化合物ライブラリーのスクリーニング
e) 哺乳類プロテアソームに対する阻害活性評価(潜在的毒性評価)
f) ヒト、マラリア原虫の20Sプロテアソームの基質選択性評価
3. プロジェクトの結果及び考察
a) マラリア原虫から20Sプロテアソーム(~300μg)を抽出し、ヒト赤血球20Sプロテアソームの混入が無いことを確認。
b) 哺乳類組換えPA28を調製し、マラリア原虫20Sプロテアソーム活性化因子として機能することを確認。
c) 武田薬品のプロテアソーム阻害薬ライブラリーに関して、マラリア原虫プロテアソームのβ1、β2、β5サブユニットに対する阻害活性を評価。
d) ヒト20Sプロテアソームの常在型および免疫プロテアソームそれぞれに対する阻害活性を131個の化合物について評価。
e) 上記評価系で用いた化合物の阻害作用の可逆性を、Calu6哺乳類細胞におけるプロテアソーム-GLO評価系で検討。
f) ヒト、マラリア原虫20Sプロテアソームの基質選択性確認のため、Ac-P3-P2-P1-AMC構造をもつ約6000個の基質ライブラリーを評価。
上記実験の結果、ヒトとマラリア原虫の常在型プロテアソームには基質選択性に差異が存在することが明らかとなった。また、マラリア原虫20Sプロテアソームのβ2、およびβ2とβ5に選択的に阻害活性を示す化合物を同定した。さらに、ヒト20Sプロテアソームに対して僅かな阻害活性を示す一方で、マラリア原虫の20Sプロテアソームを阻害しマラリアの増殖を強力に抑制する化合物を見出した。これらの化合物はヒト20Sプロテアソームに対して可逆的な阻害様式を示すことから、ヒトに対しては毒性が弱いことが明らかとなった。
また、マラリア原虫20Sプロテアソームのβ2とβ5の両方に阻害活性を示す化合物の設計が可能であることが示唆される。
基質選択性の検証結果から、マラリア原虫プロテアソームに対してはP1部にはアスパラギン酸、P2・P3部にはトリプトファンが望ましいことが判明し、今後の化合物設計方針に有用な情報である。
我々は武田薬品との間で優れた関係を確立し、最先端にいる科学者が武田薬品の保有する化合物ライブラリーにアクセスできる環境を積極的に整えた。
以上、目的とする化合物のスクリーニングプロセスの構築を完了した。
Investment
プロジェクト
耐性獲得阻害作用を有する新規マラリア治療薬としてのプロテアソーム阻害薬の研究開発




